Safety安全性
【DOP(DEHP)の安全性】
1.DOPの安全性
フタル酸エステルの汎用品のひとつであるDOPは、安全性が求められる医療用途を含め半世紀以上にわたり世界中で幅広く使用され続けていますが、ヒトに健康被害をもたらした具体的報告事例はありません。
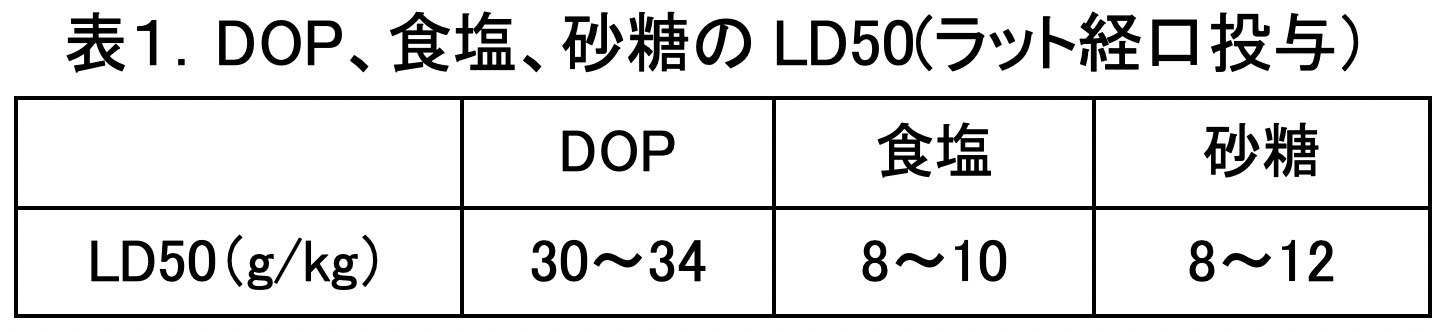
DOPの急性毒性を示すLD50値(ラット死亡率50%の場合の体重1kg当たりの経口投与量)は、下表1のように食品である食塩や砂糖より大きいため懸念はありません。また、皮膚の吸収毒性や皮膚刺激性も低く、危険な化学物質ではありません。
化学物質の安全性は、リスク(有害性及び暴露量)の定量評価結果で判断します。有害性が高くても暴露量が低いとリスクは低く評価され、有害性が低くても暴露量が高いとリスクは高く評価されます。
弊社は可塑剤工業会会員として、DOPの安全性をリスク面から調査・研究し、科学的論拠に基づいた情報として国内外にアピールしています。本稿ではその一端を下記にご紹介致しますが、その他の詳細な安全情報については可塑剤工業会HP1)をご参照ください。
1) http://www.kasozai.gr.jp/
2.DOPの有害性
主な有害性項目には、発がん性、変異原性、生殖毒性(CMR)、難分解性、生体蓄積性、内分泌かく乱性がありますが、DOPではこの内、げっ歯類での実験結果から、ヒトへの生殖毒性、発がん性、内分泌かく乱性が問題視されています。そこで、この3種の有害性に対する考え方を中心に、下記にご紹介します。
(1)生殖毒性
生殖毒性とは、生物の生殖能(生殖器官の形態異常、受精、受胎能の機能異常等)、胚・胎児への障害などの毒性のことです。DOPをげっ歯類のラットに多量投与すると精巣毒性が認められた報告結果を基に、欧州では生殖毒性「1B」に分類され、REACHにおいて認可対象物質及び制限物質に指定されました。
可塑剤工業会では、マーモセット(成獣、幼若獣、胎児)での実験結果(げっ歯類のラットで認められた精巣毒性等が霊長類のマーモセットでは認められなかった)2)-4)、ヒトを対象とした代謝プロフィールの実験結果5)及びヒト肝キメラマウスの実験結果6)(げっ歯類と比較してヒトの方がDOP代謝物の尿での早期体外排泄が認められた)より、DOPの生殖毒性には種差がある(げっ歯類のラットと霊長類のヒトでは有害性作用や代謝プロフィールが異なるので、げっ歯類の有毒性をヒトには適用できない)ことを検証しました。弊社ではその結果を基にJIS K7252に準じ、DOPを「区分に該当しない」に分類しています。
2) Kurata et al. Toxicological Science, 42:49-56, 1998.
3) Kurata et al. J. Toxicity and Environmental Health A.,69:1651-1672, 2006.
4) Kurata et al. J. Toxicol. Sci. 37:33-49, 2012
5) Adachi et al, Environ. Toxicol. Pharmacol. 39:1067-1073, 2015.
6) Kurata et al. J. Toxicol. Sci. 37:401-414, 2012
(2)発がん性
げっ歯類(ラット、マウス)で肝臓に腫瘍が発生する報告例がありますが、これはげっ歯類に特有の作用メカニズムであり、ヒトと同じ霊長類であるサルには腫瘍が発生しないことが既に確認されています。IARC(国際がん研究機関)は2000年に同結果を受け、下表2に示すDOP区分を「2B」から「3」に変更しましたが、2011年に再び「2B」に戻しました。これはヒトでの新たな証拠が見つかったのではなく、げっ歯類における発がん性のメカニズムや疫学研究のための更なる調査が必要と判断したからです。「2B」分類例としてはコーヒー、携帯電話の電波等があります。
弊社では、DOPの発がん性には生殖毒性同様に種差があると判断し、JIS K7252に準じ、「区分に該当しない」に分類しています。

(3)内分泌かく乱性
内分泌かく乱性とは、生物の内分泌系機能を変化させ、その結果として健康に有害な影響を生ずる毒性で、内分泌かく乱性を示す化学物質を「環境ホルモン」と呼ぶこともあります。環境省による「環境ホルモン戦略計画SPEED98:内分泌かく乱作用を有すると疑われる化学物質」での検討でDOPがリストアップされ、試験管レベル及び実際の動物を用いて試験した結果、女性ホルモン様作用を示さないことが確認されました。また、その後の2003年6月に環境省が行った追加検討で、DOPには男性ホルモン様作用や甲状腺ホルモン様作用について試験を行いましたが、ヒト及び生態系とも内分布かく乱作用が認められない(環境ホルモンではない)とする研究結果が発表されました。
現在、欧州を中心に農薬、抗菌剤などの分野で、内分泌かく乱性の検討が進んでおりますが、一般化学物質については未だ、その定義、判断基準、評価方法が決まっていません。
また、内分泌かく乱性については「作用」であり、「エンドポイント」は生殖毒性です。したがって、弊社では生殖毒性と同じく、DOPの内分泌かく乱性には種差があると考え、ヒトへの内分泌かく乱性はないと考えます。
(4)変異原性
変異原性とは遺伝物質であるDNAや染色体に損傷を与え、突然変異を起こす性質のことです。微生物による変異原性試験では、DOPは陰性と判定されています。弊社では上記結果を基にJIS K7252に準じ、「区分に該当しない」に分類しています。
3.DOPの暴露
DOPは常温付近の蒸気圧が低いため、放散量は低くなります。また、DOPは生物分解性が良好であり、生体蓄積性も濃縮性がない或いは低いと分類されているので、環境中或いは生体内に蓄積されることはありません。
なお、環境中の測定値として、屋外大気中の平均値は20(ng/m3)、水域(下線、湖沼、海域、地下水)は0.2(μg/L)と報告7)されていますが、水道法の要監視項目のDOP指針値60(μg/L)と比較して大幅に低い数値となっています。
7)中西準子他、詳細リスク評価書(フタル酸エステル-DEHP-)、丸善、92-106、2004
4.DOPのヒト及び環境へのリスク評価
国のリスク評価に先駆けてCERI(一般財団法人化学物質評価研究機構)が2013年に実施したヒト健康に対する化審法評価Ⅱ相当のリスク評価結果8)では、DOPの実排出源よりADMER(解析モデル)を使用して広域での5平米、1平米メッシュごとの大気中平均濃度を試算しています。試算結果が有害性評価値を上回った国内の地域は、5平米での試算ではなく、1平米での試算でも2箇所のみとなりました。なお、この時に使用されたPRTR排出量データは2009年と古く、現在のPRTRデータが半減以下となっていることをあわせて考えると、DOPのリスクは適正に管理されていることが示唆されます。
一方で、リスク評価の中で最も重要な指標は「ヒトへのリスク評価」であり、ヒトの一日当たりの体内暴露量がTDI(耐容一日摂取量:ヒトが一生涯にわたり摂取しても健康に対する有害な影響が現れないと判断される一日当たりの摂取量)を超えるかどうかにあります。DOPの体内暴露量として2011年から2014年にかけて環境省が実施した「ヒトへの暴露モニタリング調査結果」の最大摂取試算値0.456(μg/体重kg/day)、DOPのTDI値として2013年に食品安全委員会が決めた30(μg/体重kg/day)を取り上げた場合、体内暴露量はTDIと比較して2桁低い数値となり、「ヒトへのリスク評価」結果として管理レベルが非常に良好なことがわかります。
ここで、「環境へのリスク評価」についても試算してみます。可塑剤工業会独自の環境モニタリングとして1993年より、関東・関西の河川水、地下水、水道水、海水のDOP濃度を22地点で定点観測しています。いずれの測定結果も全箇所でPNEC(生態系へ影響がないとみなされる化学物質濃度)以下で、「環境へのリスク評価」結果も管理レベルが非常に良好なことがわかります。同内容の詳細は可塑剤インフォメーションNo299)を参照ください。
8)日本リスク研究学会、23巻、3号、181-191、2013
9) http://www.kasozai.gr.jp/book/

 お問い合わせ
お問い合わせ